-
欧洲儿童用药法规体系具体内容
发布时间:2024-10-27
PIP的基本要求与美国的PSP相一致。欧盟要求申请者在成人的一期临床试验结束就递交PIP,以促使儿童药物研发计划从一开始就成为整个药物研发计划的一部分。EMA收到PIP申请后,在30天内进行审查,之后儿科委员会(pediatriccommittee,PDCO)在60d内进行审评并给出意见。整个PIP的审评批准时限是140d,如果申请者需要和PDCO进一步讨论,则最长不超过290d。PDCO关于PIP的审评意见都在网上公布。
搜索
发布时间:2024-10-27
PIP的基本要求与美国的PSP相一致。欧盟要求申请者在成人的一期临床试验结束就递交PIP,以促使儿童药物研发计划从一开始就成为整个药物研发计划的一部分。EMA收到PIP申请后,在30天内进行审查,之后儿科委员会(pediatriccommittee,PDCO)在60d内进行审评并给出意见。整个PIP的审评批准时限是140d,如果申请者需要和PDCO进一步讨论,则最长不超过290d。PDCO关于PIP的审评意见都在网上公布。
 2019-08-27
2019-08-27
 2019-08-27
2019-08-27
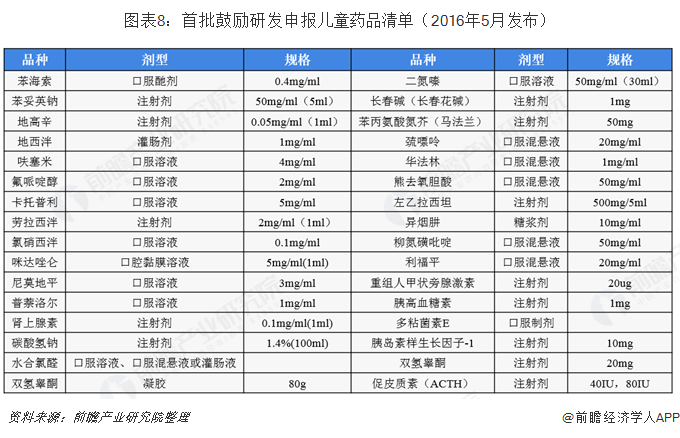 2019-08-27
2019-08-27
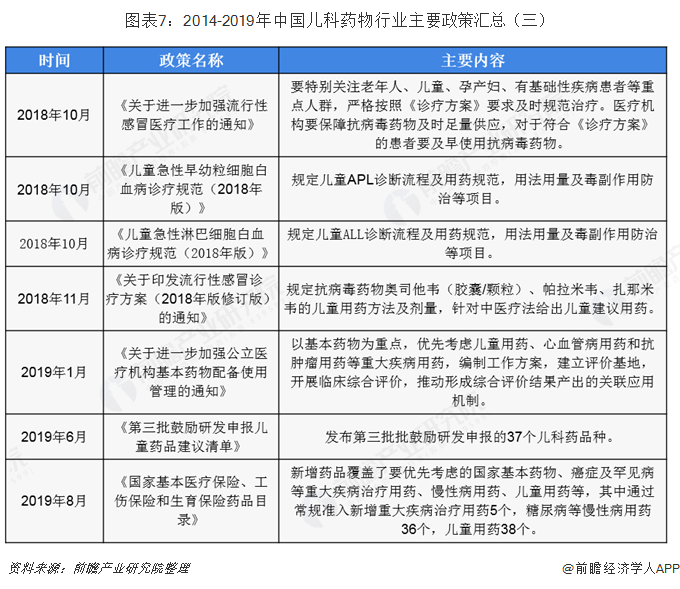 2019-08-27
2019-08-27
 2019-08-27
2019-08-27
 2019-08-27
2019-08-27
 2019-08-27
2019-08-27
 2019-08-27
2019-08-27
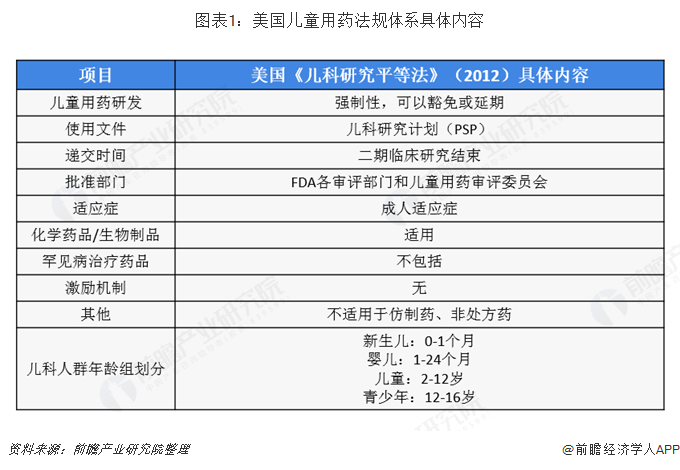 2019-08-27
2019-08-27
 2019-01-04
2019-01-04