-
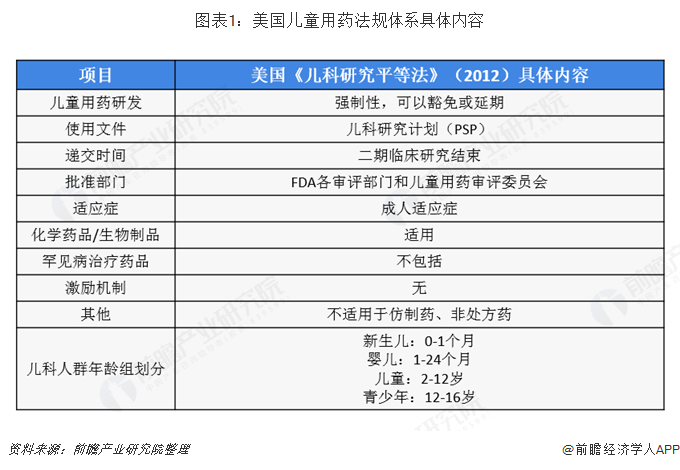
美国儿童用药法规体系具体内容
发布时间:2024-10-27
目前,美国儿科用药的两部法律根据2012年的《FDA安全与创新法》被授权长期有效,根据2012年前的PREA,未要求企业在新药研制中递交儿童用药研究计划和时间表,2012年7月之后,根据《FDA安全与创新法》的相关条款,研究者应当在新药研制的早期阶段就递交儿童用药的初期研究计划,目的是在研制成人用新药的同时,尽早考虑未来能否适用于儿童,并根据计划开展与研制同步的儿童用药试验。FDA在2016年3月颁布《儿童用药研究计划:儿童用药初期研究计划及后续修订计划的内容和程序》作为指南草案公开征求意见,并且计划颁布与《FDA安全与创新法》有关条款相衔接的法规。